清華柴繼杰研究組在《科學(xué)》發(fā)表論文
揭示NLRC4蛋白自抑制作用的分子機(jī)制
清華新聞網(wǎng)6月14日電 6月14日,清華大學(xué)生命科學(xué)學(xué)院柴繼杰教授研究組在國(guó)際頂級(jí)期刊《科學(xué)》(Science)在線發(fā)表題為《NLRC4蛋白自抑制機(jī)制的結(jié)構(gòu)基礎(chǔ)》(Crystal structure of NLRC4 reveals its autoinhibition mechanism)的研究論文,首次報(bào)道了小鼠NOD樣受體NLRC4自抑制狀態(tài)的晶體結(jié)構(gòu),并通過(guò)結(jié)構(gòu)分析和生化實(shí)驗(yàn)揭示了該蛋白維持自抑制作用的分子機(jī)制,這也是NOD樣受體家族中第一個(gè)被解析出的近乎全長(zhǎng)的蛋白質(zhì)晶體結(jié)構(gòu)。
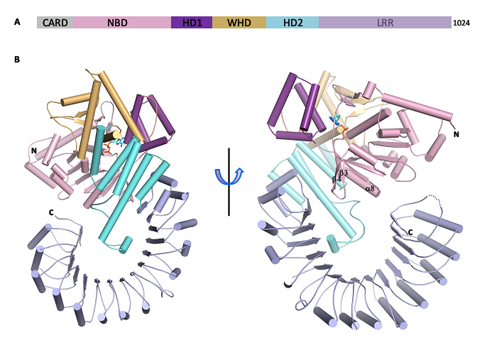
圖為小鼠NOD樣受體NLRC4自抑制狀態(tài)的晶體結(jié)構(gòu)。
清華大學(xué)生命科學(xué)學(xué)院柴繼杰教授為本文通訊作者。鄭州大學(xué)常俊標(biāo)教授、哈爾濱工業(yè)大學(xué)黃志偉教授、清華大學(xué)生命科學(xué)學(xué)院王佳偉副教授和鄧海騰教授也參與了此項(xiàng)工作。
NOD樣受體為近年來(lái)發(fā)現(xiàn)的一類(lèi)位于細(xì)胞質(zhì)內(nèi)的模式識(shí)別受體,能夠識(shí)別進(jìn)入胞內(nèi)的病原分子從而引起免疫應(yīng)答,是機(jī)體天然免疫系統(tǒng)的重要組成部分。NOD樣受體的異常與很多疾病密切相關(guān),包括如關(guān)節(jié)炎等各種自身免疫疾病、肥胖等各種代謝綜合癥、炎癥性腸病以及腫瘤的發(fā)生。對(duì)該家族蛋白作用機(jī)制的研究正成為基礎(chǔ)免疫學(xué)領(lǐng)域的一個(gè)重要的熱點(diǎn)領(lǐng)域。
目前已經(jīng)鑒定出的NOD樣受體家族至少包含22種人類(lèi)成員和34種鼠源成員。NLRC4是NOD樣受體家族中的一員,主要識(shí)別細(xì)菌的鞭毛蛋白和III型分泌系統(tǒng)的成分。NLRC4在正常情況下通過(guò)自抑制作用處于靜息狀態(tài);當(dāng)病原體成分進(jìn)入細(xì)胞內(nèi)時(shí),被NLRC4識(shí)別從而使其活化;活化的NLRC4發(fā)生自身多聚化,形成炎癥小體,產(chǎn)生一系列的免疫應(yīng)答反應(yīng)。目前對(duì)NLRC4以及該家族其它蛋白是如何維持自抑制狀態(tài)、如何識(shí)別配體以及如何激活等問(wèn)題都不清楚。
柴繼杰教授領(lǐng)導(dǎo)的研究組一直以NOD樣受體家族的結(jié)構(gòu)與功能作為主要研究方向,經(jīng)過(guò)6年的不懈努力,終于獲得了小鼠NLRC4蛋白的晶體并通過(guò)X射線晶體衍射的方法解析了該蛋白分辨率為3.2 埃的晶體結(jié)構(gòu)。結(jié)構(gòu)顯示單獨(dú)的NLRC4蛋白以單體的形式處于自抑制狀態(tài)。該蛋白中的核苷酸結(jié)合結(jié)構(gòu)域(nucleotide-binding domain,NBD)結(jié)合的是ADP,ADP介導(dǎo)的NBD同側(cè)翼螺旋結(jié)構(gòu)域(winged-helix domain,WHD)之間的相互作用對(duì)維持NLRC4的自抑制狀態(tài)十分關(guān)鍵。螺旋結(jié)構(gòu)域2(helical domain 2,HD2)通過(guò)和NBD中一段功能重要的α螺旋相互作用也參與了維持NLRC4的自抑制狀態(tài)。C末端的富含亮氨酸重復(fù)序列(leucine-rich repeat,LRR)結(jié)構(gòu)域正好處于該蛋白發(fā)生多聚化的位置,從而進(jìn)一步保證自抑制狀態(tài)的維持。當(dāng)通過(guò)氨基酸突變的方法打破NBD-WHD、NBD-HD2或NBD-LRR之間的相互作用后,這些突變體在細(xì)胞內(nèi)組成型激活NLRC4。以上的結(jié)構(gòu)和生化結(jié)果表明,NLRC4蛋白是通過(guò)以NBD為中心多個(gè)結(jié)構(gòu)域協(xié)同的方式維持自抑制狀態(tài)。NLRC4蛋白自抑制作用分子機(jī)制的揭示不僅加深了對(duì)該家族蛋白靜息狀態(tài)維持機(jī)制的認(rèn)識(shí),也為了解一些疾病相關(guān)突變體異常激活的原因提供了重要線索。
上海同步輻射光源以及日本KEK光子工廠為數(shù)據(jù)收集提供了及時(shí)有效的支持。
附 論文鏈接地址:
http://www.sciencemag.org/content/early/2013/06/12/science.1236381.full.pdf
供稿:生命學(xué)院 編輯:襄樺
