清華新聞網(wǎng)5月13日電 驅(qū)動蛋白家族作為微管細胞骨架的分子馬達,在細胞內(nèi)運輸中起著重要的作用,。與其他ATP酶類似,,驅(qū)動蛋白的活性在體內(nèi)需要受到嚴格的調(diào)控,。證據(jù)顯示,驅(qū)動蛋白激活機制的失調(diào)與神經(jīng)退行性疾病的發(fā)生有關(guān),,但細胞究竟如何指揮驅(qū)動蛋白“何時何地開工”,,至今仍是未解之謎,。
北京時間4月24日,清華大學(xué)生命學(xué)院歐光朔實驗室在《細胞生物學(xué)雜志》(Journal of Cell Biology)上發(fā)表了題為“磷酸化依賴的纖毛驅(qū)動蛋白OSM-3的區(qū)域活性調(diào)控”(Phosphorylation-dependent regional motility of the ciliary kinesin OSM-3)的研究論文,,揭示了NEK家族激酶和PP2A磷酸酶在纖毛驅(qū)動蛋白OSM-3區(qū)域活性中的調(diào)控作用,,為理解驅(qū)動蛋白活性的時空調(diào)控機制提供了全新視角。
歐光朔等實驗室的前期研究發(fā)現(xiàn),,纖毛組裝需要兩種運輸?shù)鞍捉恿ε浜希篕inesin-II負責纖毛中間段的物資運輸,,此時OSM-3處于失活狀態(tài);到達指定位置后,,Kinesin-II將任務(wù)交接給激活的OSM-3完成遠端組裝,。然而,熒光壽命顯微成像提示OSM-3在纖毛基部就已解除自抑制構(gòu)象,,說明存在一種特殊機制使其在開放構(gòu)象下仍保持失活狀態(tài),。研究人員利用體外生化實驗和質(zhì)譜技術(shù)揭示了NEKL-3激酶能夠直接磷酸化OSM-3的馬達結(jié)構(gòu)域并抑制其ATP酶活性。單分子運動實驗和微管滑動實驗也證實NEKL-3激酶能顯著抑制OSM-3的分子運動活性,。與此相反,,研究人員發(fā)現(xiàn)定位于纖毛過渡區(qū)和中間段的蛋白磷酸酶PP2A表達量增加會引發(fā)OSM-3的提前激活,而PP2A的缺失會導(dǎo)致OSM-3活性降低和纖毛變短,。這揭示了磷酸化介導(dǎo)的機制調(diào)節(jié)纖毛驅(qū)動蛋白OSM-3的區(qū)域性失活和激活,。鑒于分子的保守性,該機制也可適用于其他驅(qū)動蛋白區(qū)域活性的調(diào)控,,為分子馬達活性的精確時空調(diào)控提供了新的見解,。
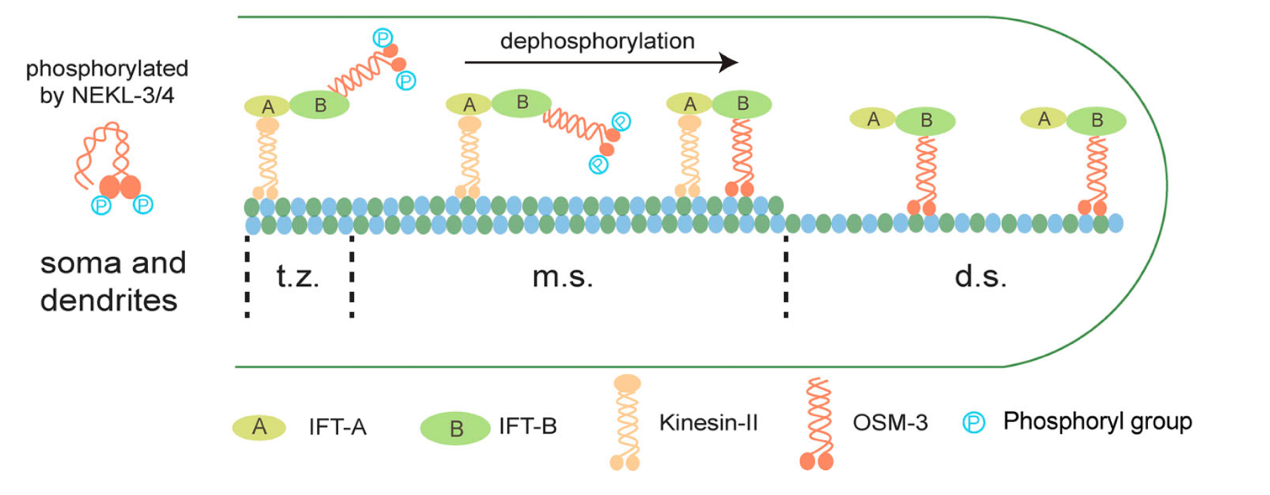
磷酸化調(diào)控纖毛驅(qū)動蛋白OSM-3區(qū)域活性機制示意圖(t.z.:纖毛過渡區(qū);m.s.:纖毛中間段,;d.s.:纖毛遠端段)
清華大學(xué)生命學(xué)院教授歐光朔為論文通訊作者,,2021級博士生黃鵬為論文第一作者。生命學(xué)院2020級博士生陳廣涵,、2019級博士生陳哲和博士后王時敏參與了部分工作,。研究得到清華-北大生命科學(xué)聯(lián)合中心、科技部,、國家自然科學(xué)基金委等的經(jīng)費資助,,以及清華大學(xué)冷凍電鏡平臺的技術(shù)支持。
論文鏈接:
https://doi.org/10.1083/jcb.202407152
供稿:生命學(xué)院
編輯:李華山
審核:郭玲
