清華新聞網(wǎng)4月26日電 內(nèi)膜系統(tǒng)的動態(tài)重塑是細胞維持區(qū)室化功能及穩(wěn)態(tài)調(diào)控的核心生物學(xué)過程,。近年來,富含內(nèi)在無序區(qū)(Intrinsically Disordered Regions, IDRs)的蛋白質(zhì)通過液-液相分離(Liquid-Liquid Phase Separation, LLPS)形成生物分子凝聚體,,通常被稱為“無膜細胞器”(Membrane-less organelle)。然而,,“無膜細胞器”概念的語義一定程度上誤導(dǎo)性地暗示了LLPS過程與膜結(jié)構(gòu)的相互排斥,,進而忽視了LLPS對細胞內(nèi)膜系統(tǒng)重塑的潛在調(diào)控作用。盡管體外實驗表明,,富含IDRs的蛋白質(zhì)可通過LLPS驅(qū)動人工囊泡膜曲率形成,,但LLPS在活細胞中是否直接參與內(nèi)膜系統(tǒng)重塑仍缺乏直接證據(jù)。該過程是否存在于生理或病理環(huán)境,?其生物學(xué)意義又是什么,?
4月23日,清華大學(xué)生命科學(xué)學(xué)院/中國科學(xué)院生物物理研究所李棟教授團隊在《分子細胞》(Molecular Cell)上發(fā)表了題為“異常相變驅(qū)動膜性細胞器重塑和腫瘤發(fā)生”(Aberrant phase separation drives membranous organelle remodeling and tumorigenesis)的研究論文,。研究團隊利用Multi-SIM超分辨率成像技術(shù),,在活細胞中證實富含IDRs的跨膜融合蛋白可通過LLPS重塑靶向內(nèi)膜系統(tǒng)。該研究以低級別纖維黏液樣肉瘤(Low-Grade Fibromyxoid Sarcoma, LGFMS)特征性融合蛋白FUS-CREB3L2(FC)為模型,,系統(tǒng)解析了異常相分離驅(qū)動膜重塑促進腫瘤發(fā)生的分子機制,,為理解LLPS與內(nèi)膜系統(tǒng)互作的生物學(xué)功能提供了新視角。
FC蛋白同時保留FUS的IDRs和CREB3L2的跨膜結(jié)構(gòu)域及DNA結(jié)合域,。通過構(gòu)建FC誘導(dǎo)表達系統(tǒng),,研究團隊利用Multi-SIM連續(xù)采集超過2300個時間點、持續(xù)6小時的動態(tài)影像,,首次捕捉到FC通過LLPS重塑內(nèi)質(zhì)網(wǎng)(Endoplasmic Reticulum, ER)的動態(tài)過程(圖1),。
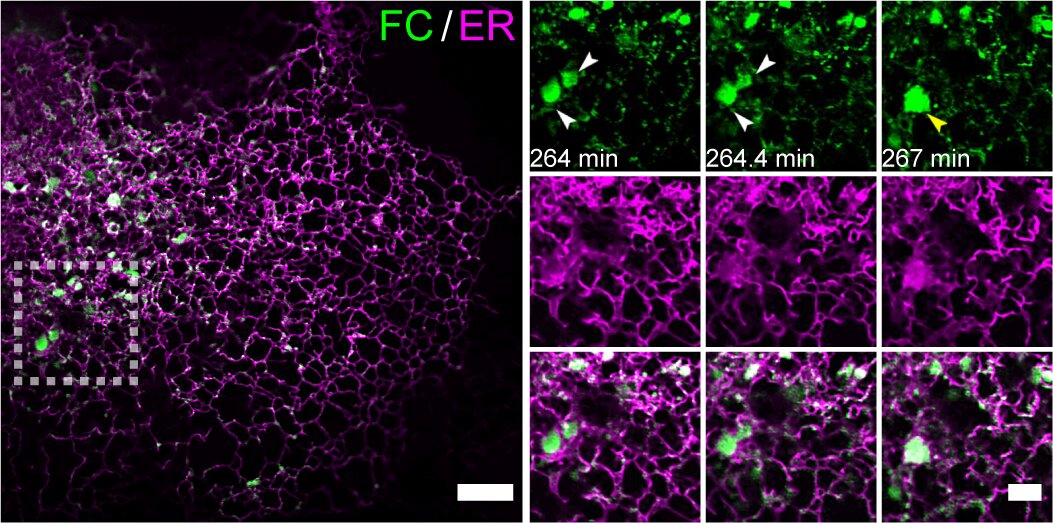
圖1.(左側(cè)大圖)來自一段代表性的時長6小時的Multi-SIM圖像,展示了FC在內(nèi)質(zhì)網(wǎng)膜上的累積凝聚效應(yīng),。實驗采用穩(wěn)定表達Tet-on系統(tǒng)調(diào)控的mEmerald-FC和mCherry-Calnexin的U2OS細胞,,在加入10 ng/mL強力霉素誘導(dǎo)2小時后進行成像。(右側(cè)小圖)左側(cè)白虛線方框區(qū)域的延時成像,,展示了FC凝聚體的動態(tài)聚結(jié)過程及其伴隨的內(nèi)質(zhì)網(wǎng)膜重構(gòu),。(比例尺:5μm左側(cè),;2μm右側(cè))
機理研究表明,F(xiàn)C重塑的ER膜結(jié)構(gòu)與COPII小泡標志物共定位,,形成直徑顯著大于經(jīng)典COPII小泡的COPII樣區(qū)室,。值得注意的是,該區(qū)室滯留了本應(yīng)通過COPII轉(zhuǎn)運至高爾基體的S1P/S2P蛋白酶,,觸發(fā)FC發(fā)生“自發(fā)性”膜內(nèi)蛋白水解,,釋放具有轉(zhuǎn)錄活性的N端(FC-N)入核(圖2A)。這與CREB3L2野生型蛋白形成鮮明對比——后者定位于ER且不改變ER膜形態(tài),,其核轉(zhuǎn)移需內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)劑布雷菲德菌素A(BFA)刺激,,在高爾基體發(fā)生“誘導(dǎo)性”切割(圖2B)。
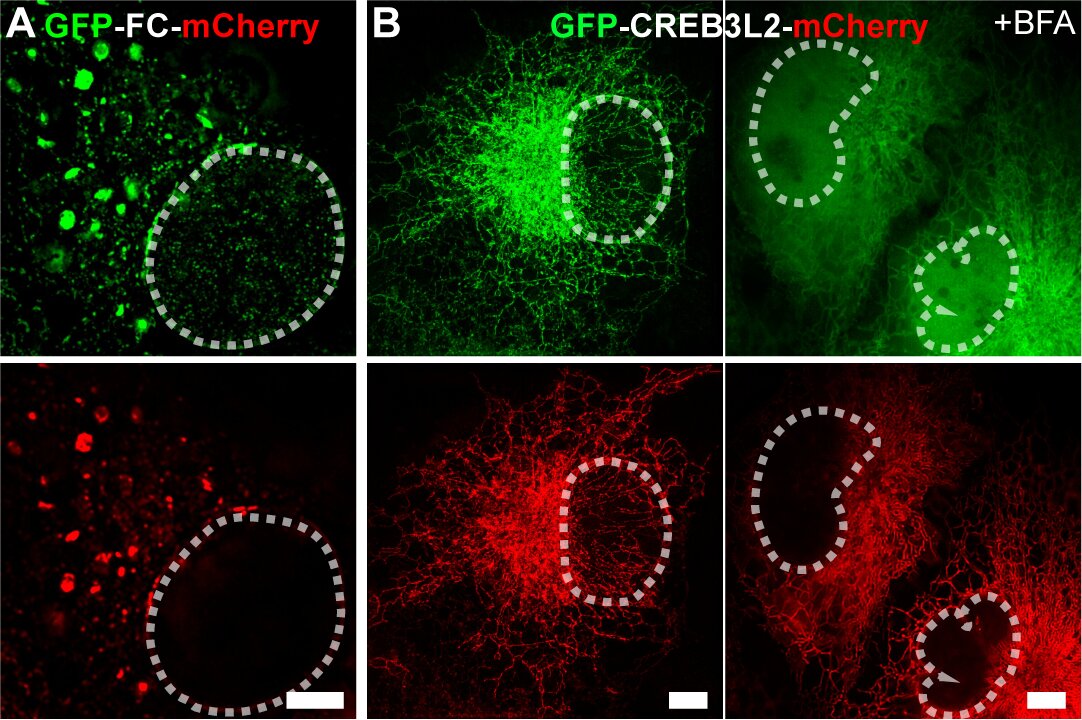
圖2.(A)GFP-FC-mCherry融合蛋白Multi-SIM圖像,,顯示FC蛋白N端片段在非刺激條件下自發(fā)發(fā)生的核轉(zhuǎn)位現(xiàn)象,;(B)GFP-CREB3L2-mCherry融合蛋白Multi-SIM圖像,揭示該轉(zhuǎn)錄因子需經(jīng)布雷菲德菌素A(BFA)處理誘導(dǎo)方可實現(xiàn)核定位,。白色虛線勾勒細胞核輪廓,。(比例尺:5μm)
在細胞核內(nèi),F(xiàn)C-N特異性募集SSRP1和CHD7形成轉(zhuǎn)錄復(fù)合物,,激活LGFMS特征性基因表達,,最終誘導(dǎo)細胞獲得惡性表型(圖3)。該研究首次闡明FC異常相分離導(dǎo)致的ER膜重塑如何傳遞至細胞核的調(diào)控路徑,,為開發(fā)靶向LGFMS的治療策略提供了重要理論依據(jù),。
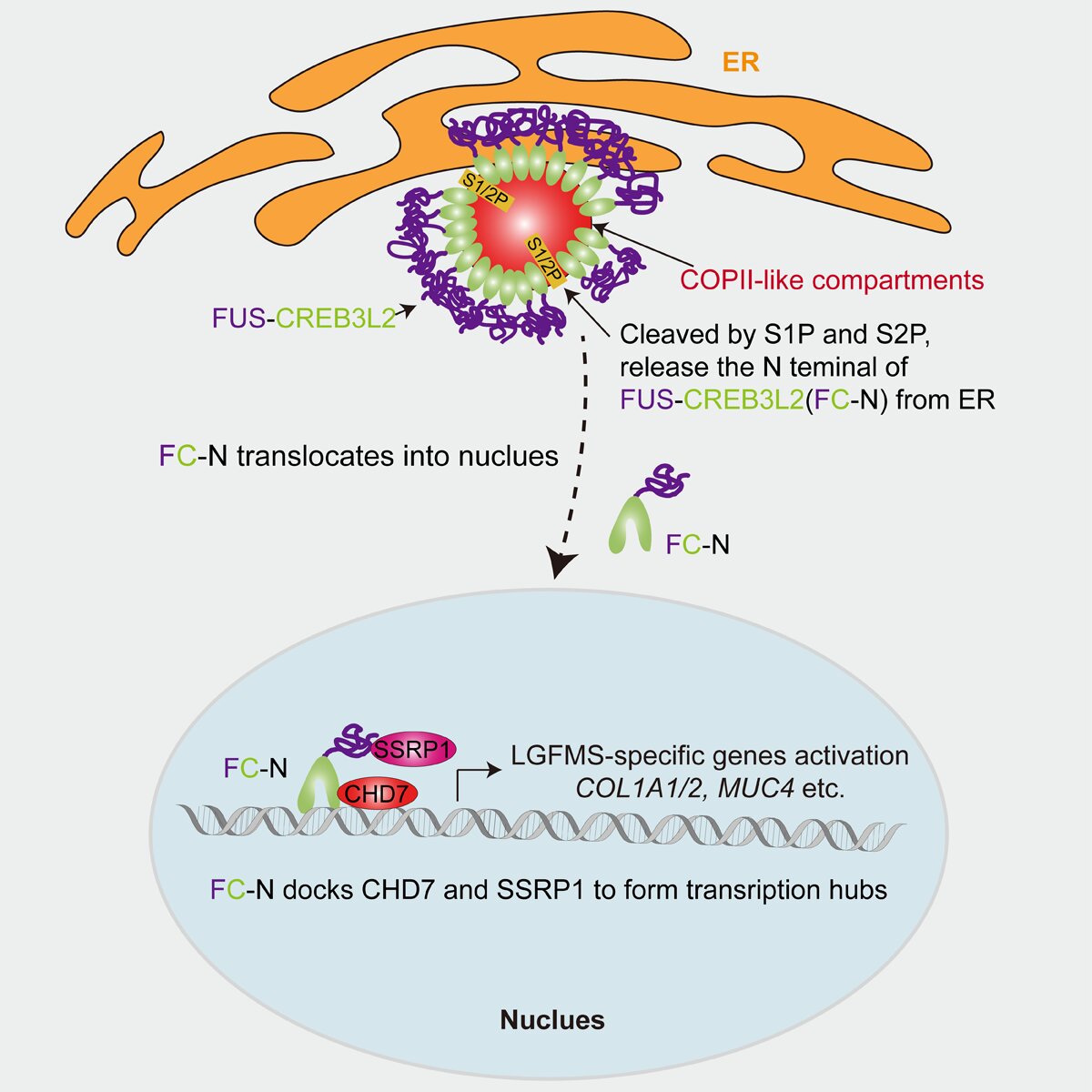
圖3.FC致癌機制示意圖。FC在內(nèi)質(zhì)網(wǎng)上通過LLPS形成COPII樣結(jié)構(gòu),。該結(jié)構(gòu)滯留原本依賴經(jīng)典COPII囊泡運輸?shù)目缒さ鞍酌窼1P/S2P,。S1P/S2P在COPII樣結(jié)構(gòu)中協(xié)同切割FC,釋放FC的N端(FC-N)入核,。FC-N入核后,,與CHD7和SSRP1形成轉(zhuǎn)錄復(fù)合物,特異性活化LGFMS相關(guān)靶基因
清華大學(xué)生命科學(xué)學(xué)院/中國科學(xué)院生物物理研究所教授李棟為論文通訊作者,,中國科學(xué)院生物物理研究所副研究員王新禹,、博士后蔣阿敏和清華大學(xué)生命科學(xué)學(xué)院博士后孟權(quán)為論文共同第一作者。研究得到科技部,、國家自然科學(xué)基金委員會以及新基石科學(xué)基金會的資助,。
論文鏈接:
https://doi.org/10.1016/j.molcel.2025.04.001
供稿:生命學(xué)院
編輯:李華山
審核:郭玲
