清華新聞網(wǎng)4月7日電 DNA纏繞組蛋白八聚體形成的核小體是染色質(zhì)的基本單元。染色質(zhì)重塑蛋白(chromatin remodeler)利用ATP水解的能量移動(dòng)核小體,,從而調(diào)節(jié)染色質(zhì)結(jié)構(gòu)與基因表達(dá),。染色質(zhì)重塑蛋白包含四個(gè)主要家族:SWI/SNF、ISWI,、CHD和INO80,,它們具有多種生物學(xué)功能。其中,,SWI/SNF幫助形成開放的染色質(zhì),,促進(jìn)基因表達(dá);而ISWI則感知接頭DNA的長(zhǎng)度,,促進(jìn)等間距核小體陣列排布,,推動(dòng)緊密染色質(zhì)結(jié)構(gòu)形成。不同的染色質(zhì)重塑蛋白具有高度保守的馬達(dá)結(jié)構(gòu)域(motor domain),,是染色質(zhì)重塑反應(yīng)的核心,。而過度的染色質(zhì)重塑反應(yīng)需被抑制,從而避免破壞染色質(zhì)結(jié)構(gòu),。染色質(zhì)重塑馬達(dá)如何克服核小體中組蛋白與DNA的相互作用,,滑移核小體的機(jī)理并不完全清楚。
4月4日,,清華大學(xué)生命學(xué)院教授陳柱成在《科學(xué)》(Science)雜志在線發(fā)表題為“活躍ATP水解過程中ISWI染色質(zhì)重塑的結(jié)構(gòu)解析”(Structuralinsights intochromatin remodeling by ISWI during active ATP hydrolysis)的研究論文,。過往的結(jié)構(gòu)研究可能由于使用不能被水解的核苷酸底物,只捕捉到三種染色質(zhì)重塑狀態(tài)(ATP,、ADP和Apo),。這個(gè)最新的研究使用ATP維持DNA滑移,讓馬達(dá)蛋白經(jīng)歷重塑循環(huán)中所有可能的構(gòu)象,。研究人員設(shè)計(jì)了不同濃度ATP實(shí)驗(yàn)條件,,富集不同狀態(tài)下的構(gòu)象,并通過冷凍電子顯微鏡技術(shù),,首次從ATP水解過程中解析出ATP,、ADP、ADP*,、ADP?,、ADP*?、Apo,、Apo*,、ADPS和ADPB等九種ISWI結(jié)合核小體的動(dòng)態(tài)結(jié)構(gòu)(分辨率2.3-3.0 ?)。這九種結(jié)構(gòu)共同組成了迄今最完整的染色質(zhì)重塑循環(huán)模型,,為解釋染色質(zhì)重塑中的DNA滑移和剎車機(jī)制奠定了基礎(chǔ),。
研究人員發(fā)現(xiàn)ISWI馬達(dá)蛋白在核小體內(nèi)部(SHL2)引起1bp DNA隆起(圖1)。這個(gè)全新構(gòu)像被命名為ADP*,,有別于經(jīng)典ADP狀態(tài)下的1/2bp DNA形變,。ADP*構(gòu)象中,DNA雙鏈同時(shí)從入口端向核小體內(nèi)部滑移,,導(dǎo)致1bp DNA隆起過渡性地儲(chǔ)存在SHL2處,,并打破DNA-組蛋白的局部相互作用。這時(shí),,ATP水解的化學(xué)能變轉(zhuǎn)換成DNA形變的勢(shì)能,。這一現(xiàn)象與兩種被廣泛關(guān)注的染色質(zhì)重塑機(jī)制存在沖突。這既不同于“扭曲傳播”(twist diffusion)模型中DNA-組蛋白相互作用保持完整的情況,,也有別于“環(huán)傳播”(loop propagation)模型中多個(gè)相鄰位點(diǎn)相互作用同時(shí)被破壞的特征,。ADP*狀態(tài)的發(fā)現(xiàn)找到了染色質(zhì)重塑循環(huán)中缺失的關(guān)鍵拼圖,提示一種新的DNA形變傳播模式,。

圖1.存儲(chǔ)1bp DNA隆起的ADP*狀態(tài)結(jié)構(gòu),。(A)ADP*狀態(tài)下,DNA隆起的電鏡密度圖,。(B)局部DNA-組蛋白相互作用分析,。ATP狀態(tài),灰色,;ADP*狀態(tài),,彩色。在ADP*狀態(tài)下,,DNA與組蛋白局部相互作用被破壞,。(C)相對(duì)于ATP狀態(tài),ADP*狀態(tài)的DNA磷酸骨架位移距離熱圖,。ADP*狀態(tài)下,,兩股DNA鏈從入口端向核小體內(nèi)部移動(dòng)(箭頭方向),1bp DNA形變儲(chǔ)存在SHL2位置,。(D)ATP狀態(tài)(灰色)與ADP*狀態(tài)(彩色)位于SHL2處的DNA結(jié)構(gòu)對(duì)比
研究還發(fā)現(xiàn)了ISWI的多個(gè)特異調(diào)控構(gòu)象:ADP?,、ADP*?、ADPS以及ADPB。ADP?和ADP*?具有正向調(diào)控元件:RYA(arginine-tyrosine anchor)和PosC(圖 2A-C),。ADP?和ADP*?構(gòu)象常見于核小體接頭DNA較短一側(cè),,可能起到彌補(bǔ)DNA結(jié)合結(jié)構(gòu)域(DBD)錨定不足的作用,從而穩(wěn)定馬達(dá)對(duì)核小體的結(jié)合,,促進(jìn)染色質(zhì)重塑活性,。相反,在ADPB狀態(tài)下,,正向調(diào)控元件作用消失,,而新生成的Brake元件通過變構(gòu)作用,導(dǎo)致馬達(dá)蛋白異常開放,,從而落入失活狀態(tài)(圖2D-E),。據(jù)此,研究人員提出了染色質(zhì)重塑的剎車機(jī)制,,闡明了ISWI家族特異的接頭DNA感知機(jī)制,。
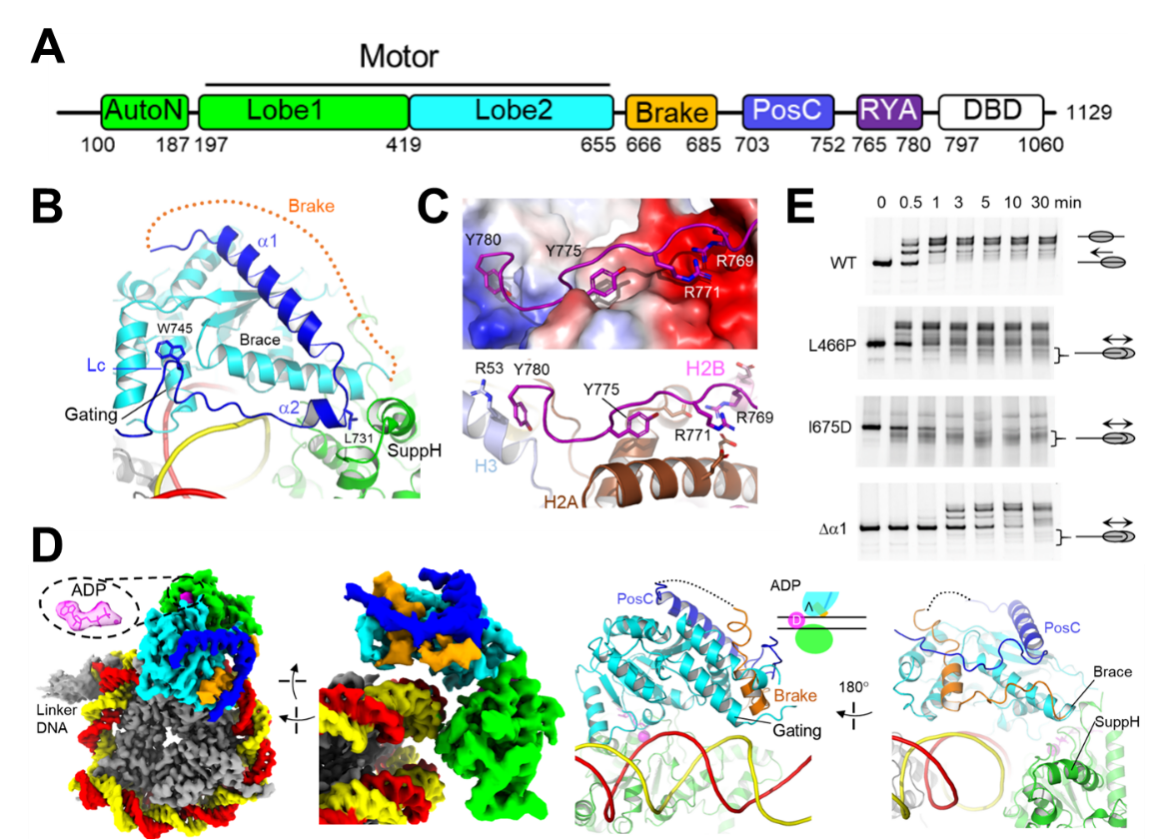
圖2.ISWI調(diào)控狀態(tài)的結(jié)構(gòu)。(A)ISWI結(jié)構(gòu)域示意圖,。(B)ADP+的PosC(深藍(lán))結(jié)構(gòu),。(C)ADP+的RYA結(jié)構(gòu)。上圖展示組蛋白表面電勢(shì),。(D)ADPB的結(jié)構(gòu),,Brake(橙色)。(E)ISWI的核小體滑移(居中)活性分析,。野生型(WT)ISWI感知接頭DNA長(zhǎng)度,,使核小體從DNA末端滑移至中間位置,產(chǎn)生遷移較慢條帶,。三種Brake作用的突變體,,破壞ISWI感知接頭DNA長(zhǎng)度的能力,從而形成遷移較快條帶
研究人員綜合所獲得的九種構(gòu)像,,提出一個(gè)多步驟染色質(zhì)重塑模型,,包括核心的重塑循環(huán)和外圍的調(diào)控狀態(tài)(圖3)。在核心重塑循環(huán)中,,ATP水解釋放無機(jī)磷酸,,馬達(dá)經(jīng)歷ATP至ADP構(gòu)像轉(zhuǎn)變,并在SHL2位置引發(fā)1/2bp的DNA形變,。馬達(dá)蛋白進(jìn)一步傾轉(zhuǎn),,進(jìn)入ADP*狀態(tài),引發(fā)1bp DNA隆起,。隨后,,ADP*馬達(dá)蛋白在整體構(gòu)像不變的情況下釋放ADP,,進(jìn)入Apo*狀態(tài)。新一輪ATP結(jié)合促使馬達(dá)蛋白閉合,,馬達(dá)的定向運(yùn)動(dòng)推動(dòng)DNA鏈前移,,防止DNA逆滑。同時(shí),,馬達(dá)內(nèi)部結(jié)構(gòu)發(fā)生調(diào)整,,釋放與DNA鏈的緊密接觸,使1bp DNA隆起向出口方向滑移,,DNA恢復(fù)松弛狀態(tài)。
染色質(zhì)重塑周期中,,DNA在ADP和ADP*狀態(tài)下發(fā)生形變,,使體系處于高能狀態(tài),這是調(diào)控染色質(zhì)重塑活性的關(guān)鍵節(jié)點(diǎn),。馬達(dá)在RYA和PosC作用下,,可以穩(wěn)定在APD+和ADP*?構(gòu)象,否則容易滑入失去活性的ADPS和ADPB狀態(tài),。ADPS的結(jié)構(gòu)代表ATP水解的能量未有效轉(zhuǎn)換為DNA形變的狀態(tài)(打滑狀態(tài)),。未來需要更多研究分析能量的轉(zhuǎn)換效率。當(dāng)核小體滑移使得接頭DNA變得較短時(shí),,DBD失去錨定位點(diǎn),,馬達(dá)蛋白剎車,進(jìn)入ADPB狀態(tài),,從而避免過度的染色質(zhì)重塑,,實(shí)現(xiàn)對(duì)接頭DNA長(zhǎng)度的應(yīng)答??傊?,研究人員認(rèn)為,核心重塑循環(huán)是各染色質(zhì)重塑蛋白中普遍通用的DNA滑移機(jī)制,,而外圍調(diào)控層則為ISWI家族特有,。
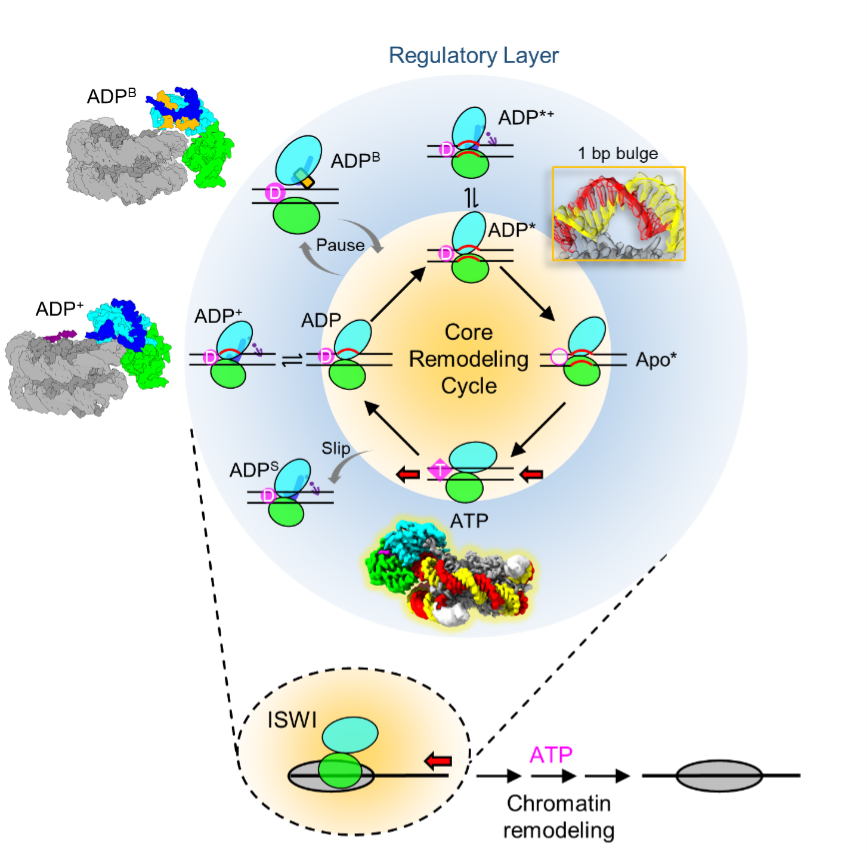
圖3.染色質(zhì)重塑DNA滑移和調(diào)控模型
陳柱成為論文通訊作者,清華大學(xué)生命學(xué)院2020級(jí)博士生謝悠揚(yáng)和博士后潘涵為論文共同第一作者,。博士后陳康凈參與了重要工作,。研究得到國(guó)家自然科學(xué)基金、科技部重大科學(xué)研究計(jì)劃專項(xiàng),、北京生物結(jié)構(gòu)前沿研究中心,、清華-北大生命科學(xué)聯(lián)合中心、國(guó)家蛋白質(zhì)科學(xué)研究(北京)設(shè)施清華基地的大力支持,。
相關(guān)論文:
https://doi.org/10.1126/science.adu5654
供稿:生命學(xué)院
編輯:李華山
審核:郭玲
