清華新聞網(wǎng)2月12日電 近日,清華大學生物醫(yī)學交叉研究院李超課題組在《美國化學會志》(Journalof the American ChemicalSociety JACS)上發(fā)表題為“DMOA衍生的萜類化合物的全合成:在(+)-Berkeleyacetal D 和(+)-Peniciacetal I的合成中實現(xiàn)選擇性”(Total Synthesis of DMOA-Derived Meroterpenoids: Achieving Selectivity in the Synthesis of (+)-Berkeleyacetal D and (+)-Peniciacetal I)的論文,,首次實現(xiàn)高氧化態(tài)DMOA雜萜berkeleyacetal D和peniciacetal I的不對稱全合成,。該工作通過一系列創(chuàng)新性策略攻克了復雜分子骨架構建與多重選擇性控制難題。
DMOA來源的雜萜是一類生源上由萜類前體法尼基焦磷酸和3,5-二甲基苔色酸(DMOA)經(jīng)多步酶催化反應后形成的天然產(chǎn)物,。目前,,已有超過200個該類天然產(chǎn)物被分離報道。此類天然產(chǎn)物結構復雜多樣,,同時兼具抗炎,、抗腫瘤等顯著生物活性,吸引了很多化學合成課題組的關注,。例如,,加州大學伯克利分校(UC Berkeley )的馬蒙(Maimone)課題組、耶魯大學(Yale)的紐豪斯(Newhouse)課題組,、北京大學的黎后華課題組和蘭州大學的謝志翔課題組,,在近幾年先后完成了DMOA-雜萜家族中berkeleyone A及其同系物的全合成。2022年波士頓大學(Boston University)的波科(Porco)課題組完成了一類螺環(huán)DMOA雜萜的全合成,。在李超課題組發(fā)表該合成工作的同時,,北京大學的楊震課題組在JACS發(fā)表了一篇關于DMOA-雜萜janthinoid A的全合成工作。但目前關于DMOA-雜萜中berkeleyacetals亞型天然產(chǎn)物(大于50個天然產(chǎn)物)的全合成還沒有報道,,這主要是緣于其極其復雜的化學結構和高度的氧化態(tài),。以本合成工作中的berkeleyacetal D為例:在分子結構上,其分子骨架包含6/7/6/5/6五環(huán)稠合體系,,骨架上18個碳原子中17個被官能團化或構成立體中心(含8個手性中心),。從生源合成角度上看,從已被合成攻克的berkeleyone A到本研究的berkeleyacetal D需要經(jīng)過10多步轉化,,雖然目前這些生源轉化還沒有被完全揭示清楚,。從氧化態(tài)上看,該分子氧化程度之高令人驚嘆,,其分子式C24H26O7,,碳氫比例接近1:1。
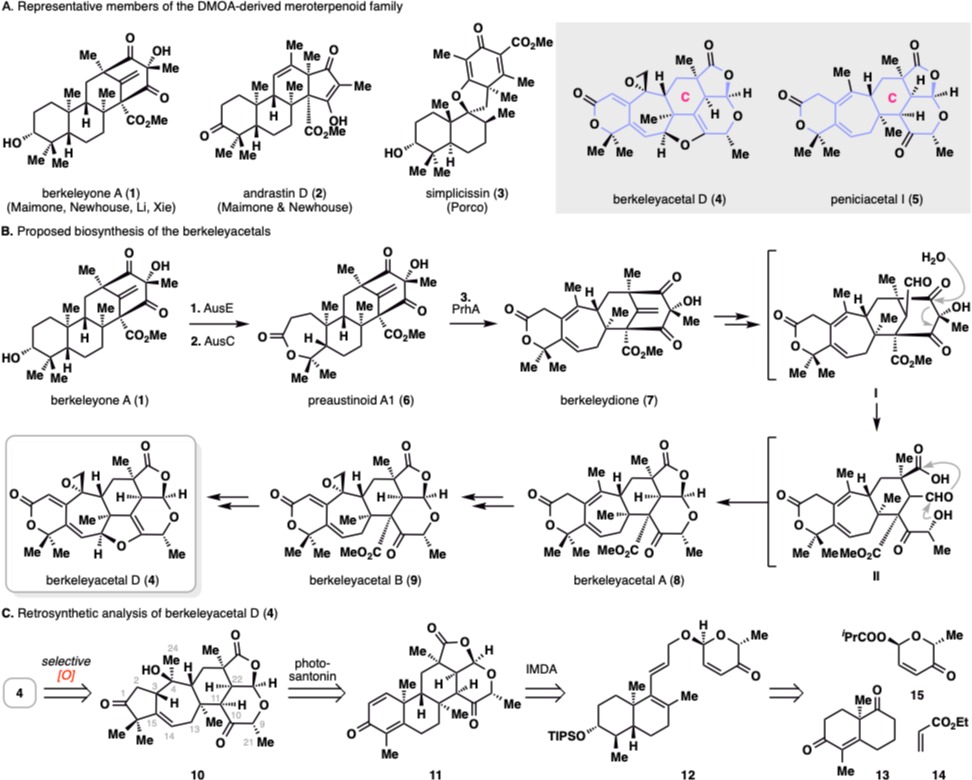
此前合成的代表性DMOA雜萜和berkeleyacetal D和peniciacetal I的分子結構,,berkeleyacetal D的生源合成及逆合成分析
在本研究中,李超課題組針對berkeleyacetal D和peniciacetal I的復雜結構提出了一種選擇性導向的合成策略,,通過一系列化學選擇性(chemoselective),、區(qū)域選擇性(regioselective)和立體選擇性(stereoselective)的化學轉化,,成功完成了(+)-berkeleyacetal D和(+)-peniciacetal I的化學全合成。此外,,在此合成中,,研究人員還發(fā)現(xiàn)了兩個非常新穎的化學轉化:六氟苯參與的立體選擇性環(huán)氧化反應和共軛烯醇負離子對三級溴化物的單電子還原構建二氫呋喃的反應。下面列舉該合成中的幾個關鍵合成步驟:
研究人員通過路易斯酸AlCl3的精準調控,,在低溫下實現(xiàn)了三烯化合物12的分子內endo-selectiveDiels–Alder反應,,成功構建了目標天然產(chǎn)物中擁擠的C環(huán)結構。而如果直接通過加熱進行Diels–Alder反應,,則會立體選擇性地獲得exo環(huán)化產(chǎn)物,。
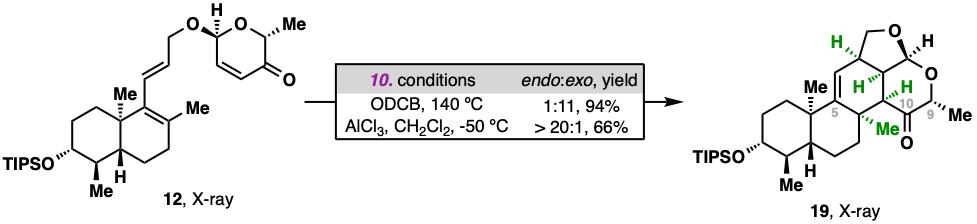
Endo-selective Diels–Alder反應構建分子骨架
鑒于目標天然產(chǎn)物分子的復雜性和高氧化性,除了上述endo-selective Diles–Alder反應,,在此合成路線中,,還涉及到非常多的選擇性問題,而這些選擇性的問題都被研究人員通過反應條件的優(yōu)化進行解決,,包括化學選擇性和立體選擇性的甲基化反應,、Baeyer-Villiger氧化反應、三級醇的脫水反應,、酮的a,b-脫氫反應,、氫化反應等。
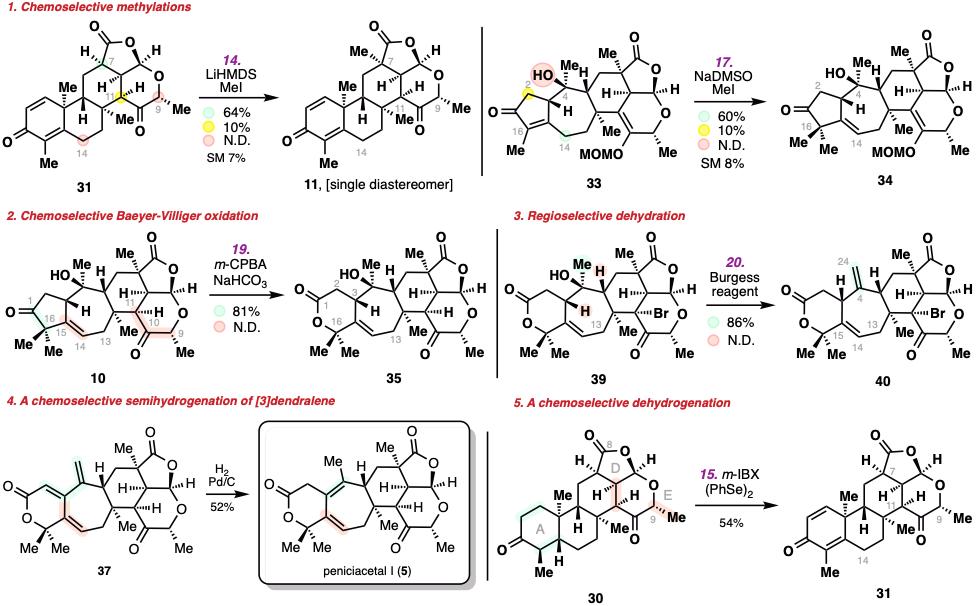
復雜分子上實現(xiàn)多重化學選擇性的突破
在構建berkeleyacetal D關鍵的C4–C24環(huán)氧化步驟中,,常規(guī)條件產(chǎn)生不利的β-面環(huán)氧化物。團隊發(fā)現(xiàn)六氟苯(HFB)作為共溶劑可能通過π-給受體作用改變反應過渡態(tài),,將α-面環(huán)氧化產(chǎn)物的比例從1:2.4逆轉為2.3:1,,收率高達93%。

溶劑參與的立體選擇性環(huán)氧化的新發(fā)現(xiàn)
最后一步,,研究人員通過化學選擇性去質子化即直接獲得了目標天然產(chǎn)物berkeleyacetal D,,詳細的機理研究表明這步化學轉化的機理涉及共軛烯醇負離子通過分子內單電子轉移(SET)還原分子內的三級溴化物,進而巧妙地實現(xiàn)2,3-二氫呋喃環(huán)的構建,。此外,,機理研究表明,光照可促進該過程,,但研究人員最終選擇不額外加光的條件以避免副反應。
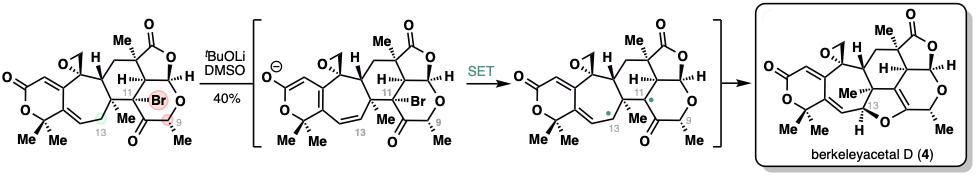
新型分子內單電子轉移構建二氫呋喃環(huán)
該工作不僅填補了DMOA-雜萜全合成領域的空白,,更展示了多重選擇性控制策略在復雜分子合成中的價值,。此外,這些在復雜分子上實現(xiàn)的這些選擇性,,將會很好地促進DMOA-雜萜及其他復雜天然產(chǎn)物的合成工作,。更重要的是,研究人員發(fā)現(xiàn)的六氟苯參與的立體選擇性環(huán)氧化和共軛烯醇負離子對三級溴化物的單電子還原反應對相應合成方法學的開發(fā)也具有啟發(fā)意義,凸顯了天然產(chǎn)物全合成促進合成化學發(fā)展的重要性,。
李超實驗室2019級PTN項目的張建鵬博士為論文的第一作者,。李超研究員為論文的通訊作者。李超實驗室2021級博士生駱筱桐和2024級博士生張靖富對本工作有重要貢獻,。北京大學羅佗平教授,、斯克里普斯(Scripps)研究所菲爾·巴蘭(Phil S. Baran)教授以及北京大學醫(yī)學部黎后華教授為研究提出寶貴意見。協(xié)和藥物所胡友財教授,、北京中醫(yī)藥大學史社坡教授,、海南師范大學陳光英教授、中山大學佘志剛教授提供天然產(chǎn)物原始譜圖,。研究得到北京生命科學研究所和清華大學的支持,。
論文鏈接
https://pubs.acs.org/doi/10.1021/jacs.4c15205
供稿:生物醫(yī)學交叉研究院
編輯:肖零
審核:郭玲
