清華李海濤課題組在《自然》和《基因與發(fā)育》連續(xù)發(fā)文
破譯“組蛋白密碼”識別新機制
清華新聞網(wǎng)3月4日電 清華大學醫(yī)學院基礎醫(yī)學系和結構生物學中心李海濤課題組日前在國際權威學術期刊《自然》(Nature, 2014年3月2日)和《基因與發(fā)育》(Genes & Dev,2014年3月3日)在線發(fā)表兩篇論文,從結構生物學角度解析組蛋白甲基化修飾識別新機制,進一步揭開錯綜復雜的表觀遺傳調控(epigenetic regulation)的神秘面紗。
真核生物基因表達調控不僅依賴于特定的DNA 序列元件,而且還受到特定組蛋白翻譯后修飾的精密調節(jié)。目前鑒定出的組蛋白修飾化學類型已超過25種,包括甲基化,酰基化,磷酸化等。這些組蛋白修飾及其組合被認為構成一組廣義上的“組蛋白密碼”,是表觀遺傳調控的重要機制之一。此外,各種組蛋白(H1,H2A, H2B,H3和H4)還普遍存在不同的序列變體。組蛋白變體和組蛋白修飾賦予組蛋白巨大的信息荷載能力,參與構成一層超越DNA序列的表觀遺傳信息,在染色質結構調節(jié)及基因表達調控等過程中起著關鍵作用。目前發(fā)現(xiàn)很多疾病與組蛋白修飾異常有著非常重要的關聯(lián),因此研究組蛋白修飾的產(chǎn)生,消除以及讀取機制,對深入了解基因功能調控機制以及疾病的發(fā)生和治療等都有著重要意義。
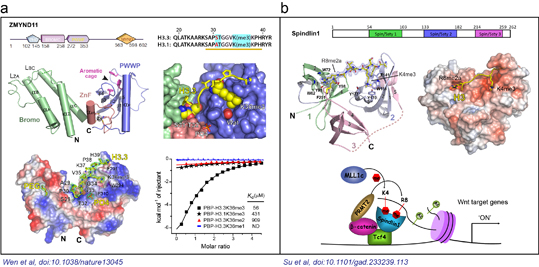
圖1. a) 組蛋白H3.3K36me3被ZMYND11串聯(lián)Bromo-ZnF-PWWP結構域識別;b)組蛋白H3“K4me3-R8me2a”被Spindlin1串聯(lián)Spin/Ssty結構域組合識別。
發(fā)表在《自然》上的論文在原子水平精細闡釋了一種腫瘤抑制因子ZMYND11利用其串聯(lián)“Bromo-ZnF-PWWP”結構域識別組蛋白變體H3.3K36me3修飾的分子機制(圖1a)。功能實驗與生物信息學分析進一步表明ZMYND11通過識別組蛋白H3.3K36me3修飾,在轉錄延伸水平抑制了腫瘤發(fā)生相關基因的過度表達,進而抑制腫瘤發(fā)生。該論文首次揭示出生物體內存在組蛋白變體特異的甲基化識別蛋白。這種對組蛋白變體和甲基化修飾類型的雙重識別,是組蛋白修飾識別機制上的新亮點,體現(xiàn)了真核生物表觀遺傳調控的復雜性和重要性。本論文是在清華大學李海濤實驗室,美國德克薩斯大學安德森癌癥中心的施曉冰助理教授實驗室以及美國貝勒醫(yī)學院的李蔚助理教授實驗室的通力協(xié)作下完成的。整個研究涵蓋了結構生物學、細胞生物學,和功能基因組學等內容,充分體現(xiàn)了當前生命科學研究中多學科深度交叉的趨勢。作為共同通訊作者,李海濤課題組負責論文中的結構生物學和生物物理結合實驗部分。李海濤課題組博士后李元元為本文共同第一作者,實驗室研究助理任永峰參與了該項工作。
發(fā)表在《基因與發(fā)育》雜志上的論文報導了Spindlin1蛋白特異識別一種新型組蛋白甲基化修飾組合H3“K4me3─R8me2a”的分子結構基礎,并結合細胞生物學研究,探討了該識別在結腸癌Wnt信號通路中的激活調控作用(圖1b)。Spindlin1是Spin/Ssty家族成員之一,參與細胞周期的調控,在多種腫瘤中高表達。結構研究表明Spindlin1分別通過串聯(lián)Spin/Ssty結構域2和1特異性識別組蛋白H3K4me3和H3R8me2a甲基化修飾;利用等溫量熱滴定法測定該識別的結合常數(shù)高達45納摩爾,是目前已報導的結合力最強的組蛋白修飾識別事件,充分顯示了組蛋白修飾多價態(tài)識別的潛力。清華大學醫(yī)學院李海濤特別研究員和生命科學院吳畏教授是本論文共同通訊作者;醫(yī)學院2010級博士研究生蘇曉楠和生命科學學院博士后朱貴欣為該論文共同第一作者;清華大學生命科學院2010級本科生(清華學堂班)學生丁霄哲同學是本論文第三作者。本論文合作研究小組還包括美國密歇根大學竇亞麗副教授,北京生命科學研究所的朱冰研究員等。
李海濤博士于2010年1月受聘為清華大學醫(yī)學院特別研究員,主要從事結構表觀遺傳學研究。他曾于2007年與合作者洛克菲勒大學C. David Allis教授一起在《自然綜述:分子細胞生物學》(Nat Rev Mol Cell Biol 8: 983-994)撰寫綜述正式提出組蛋白修飾的多價態(tài)組合識別學說;并于2011年分別在《自然-結構分子生物學》(Nat StructMolBiol 18: 769-776)(通訊作者)和《細胞》(Cell 145: 692-706)(第二作者)雜志發(fā)表論文報導人類ATRX綜合征蛋白特異識別組蛋白H3“K4me0-K9me3”甲基化修飾組合,以及人類BPTF蛋白在核小體水平特異識別組蛋白H3甲基化和H4乙酰化修飾組合的研究成果。本次工作是時隔兩年多后,李海濤課題組在組合型組蛋白修飾識別方面作出的新突破。相關研究成果不僅有助于揭示組蛋白修飾調控和人類疾病與健康的關系,也為后續(xù)表觀遺傳因子靶向的小分子藥物開發(fā)奠定了基礎。
以上研究得到科技部973計劃,國家基金委自然科學基金,教育部新世紀優(yōu)秀人才計劃,清華大學221人才計劃,中國博士后科學基金,清華-北大生命科學聯(lián)合中心等資助。衍射數(shù)據(jù)收集得到上海同步輻射光源以及北京同步輻射光源的大力支持與協(xié)助。
文章鏈接:
1)http://www.nature.com/nature/journal/vaop/ncurrent/full/nature13045.html
2)http://genesdev.cshlp.org/cgi/doi/10.1101/gad.233239.113
供稿:醫(yī)學院 編輯:襄樺
