清華大學(xué)醫(yī)學(xué)院李海濤課題組《細(xì)胞》發(fā)文破譯組蛋白乙酰化密碼
清華新聞網(wǎng)10月24日電 清華大學(xué)醫(yī)學(xué)院基礎(chǔ)醫(yī)學(xué)系和結(jié)構(gòu)生物學(xué)中心李海濤研究團(tuán)隊于10月23日在國際學(xué)術(shù)期刊《細(xì)胞》(Cell)發(fā)表了題為“AF9 YEATS domain links histone acetylation to DOT1L-mediated H3K79 methylation”(AF9 YEATS結(jié)構(gòu)域關(guān)聯(lián)組蛋白乙酰化至DOT1L介導(dǎo)的組蛋白H3第79位賴氨酸甲基化)的研究論文,發(fā)現(xiàn)了一種新型組蛋白乙酰化閱讀器-YEATS結(jié)構(gòu)域,揭開了組蛋白乙酰化轉(zhuǎn)錄調(diào)控研究新篇章。
真核生物基因組DNA 是以染色質(zhì)形式存在的。染色質(zhì)凝聚、松弛結(jié)構(gòu)的形成,以及開放、閉合等狀態(tài)的轉(zhuǎn)換提供了一種超越DNA 序列本身的調(diào)控機制,即表觀遺傳調(diào)控。表觀遺傳調(diào)控具體機制涉及組蛋白修飾、組蛋白變體、DNA 甲基化、非編碼RNA,及染色質(zhì)重塑等。其中組蛋白翻譯后修飾,被認(rèn)為構(gòu)成一類超越基因序列的“組蛋白密碼”,控制著遺傳信息的組織層次及其在染色質(zhì)層面的解讀。組蛋白賴氨酸乙酰化是研究最早的一類組蛋白修飾。表觀遺傳學(xué)的興起就是源于1996年組蛋白乙酰化轉(zhuǎn)移酶和去乙酰化酶轉(zhuǎn)錄調(diào)控功能的發(fā)現(xiàn)。組蛋白乙酰化與基因活化關(guān)系密切,其中一個重要工作模型就是乙酰化組蛋白可以被特定閱讀器結(jié)構(gòu)域所識別,從而招募染色質(zhì)調(diào)控因子到特定區(qū)域,協(xié)同完成基因表達(dá)調(diào)控。比較為人熟知的賴氨酸乙酰化閱讀器是溴域(Bromodomain),目前數(shù)個溴域靶向的一類新藥已處于臨床試驗階段。
發(fā)表在《細(xì)胞》上的論文首次證明YEATS結(jié)構(gòu)域是一類新型組蛋白乙酰化修飾“閱讀器”。通過晶體結(jié)構(gòu)解析,李海濤研究組在2.3埃分辨率水平闡釋了AF9蛋白YEATS結(jié)構(gòu)域特異識別組蛋白H3賴氨酸9位乙酰化(H3K9ac)的分子機制。研究發(fā)現(xiàn),AF9 YEATS具有免疫球蛋白家族八鏈β三明治骨架,與由四股α螺旋構(gòu)成的溴域截然不同,代表了一種全新折疊類型的組蛋白閱讀器;AF9 YEATS對乙酰化賴氨酸的特異識別由一種絲氨酸內(nèi)襯的三明治芳香籠口袋實現(xiàn),該口袋尺寸剛好適合扁平的乙酰化賴氨酸插入,并介由拉力氫鍵、碳?xì)?π等相互作用強化,實現(xiàn)對乙酰化修飾類型的特異性識別;組蛋白乙酰化位點特異性由YEATS對H3K9ac的周邊序列的識別所決定;構(gòu)成乙酰化識別口袋的關(guān)鍵殘基在不同YEATS結(jié)構(gòu)域中高度保守,而參與周邊序列識別的殘基差異較大,提示乙酰化賴氨酸識別是YEATS結(jié)構(gòu)域的一個共同功能,而不同YEATS能夠識別不同乙酰化位點,對應(yīng)于不同的基因表達(dá)調(diào)控功能。
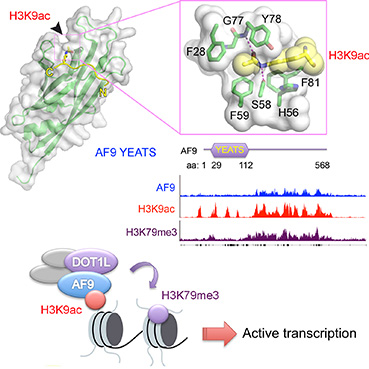
AF9 YEATS結(jié)構(gòu)域(綠色)識別H3K9乙酰化多肽(黃色)的復(fù)合物結(jié)構(gòu)及AF9-DOT1L互作促進(jìn)基因轉(zhuǎn)錄調(diào)控示意圖。
AF9蛋白是一類重要的轉(zhuǎn)錄調(diào)控因子,可以分別與組蛋白H3K79甲基化轉(zhuǎn)移酶DOT1L和超級延伸復(fù)合物(SEC)形成復(fù)合物,在轉(zhuǎn)錄起始-延伸轉(zhuǎn)換過程中發(fā)揮著重要調(diào)控作用。同時,臨床遺傳學(xué)研究表明AF9基因和MLL基因的融合(MLL-AF9)作為最常見的MLL重排類型,是導(dǎo)致人類急性髓細(xì)胞白血病(AML)以及急性淋巴性白血病(ALL)等疾病的驅(qū)動性因素。進(jìn)一步的細(xì)胞生物學(xué)和功能基因組學(xué)研究發(fā)現(xiàn),人AF9與H3K9ac修飾在全基因組水平有強烈的共定位,并且調(diào)控了包括MYC、BMP2、HOXA基因簇在內(nèi)的細(xì)胞增殖分化基因的表達(dá);此外,本研究首次表明AF9通過識別組蛋白H3K9乙酰化修飾,招募DOTL1到特定染色質(zhì)區(qū)段,促進(jìn)了組蛋白H3K79甲基化的共沉積和基因活化,揭示出一種新型組蛋白修飾交叉會話機制,體現(xiàn)了真核生物表觀遺傳調(diào)控的復(fù)雜和精密性。
目前自然界中鑒定出的含有YEATS結(jié)構(gòu)域的蛋白已達(dá)數(shù)百個,遍布于70多個不同物種,從酵母到人類都保守存在。因此,本工作是繼1999年把溴域定義為組蛋白乙酰化閱讀器后,組蛋白乙酰化識別調(diào)控領(lǐng)域的一個重要突破,開啟了組蛋白乙酰化轉(zhuǎn)錄調(diào)控研究新方向。含有YEATS結(jié)構(gòu)域的蛋白因子,如AF9、ENL、GAS41等,不僅與轉(zhuǎn)錄調(diào)控密切相關(guān),它們的調(diào)控異常通常會導(dǎo)致白血病、癌癥等人類疾病的發(fā)生。值得注意的是,雖然YEATS與溴域擁有類似的乙酰化賴氨酸識別功能,目前針對溴域乙酰化識別口袋的抑制劑(+)-JQ1對YEATS毫無效果,體現(xiàn)了YEATS乙酰化識別口袋的獨特性。因此,本研究成果不僅揭示了組蛋白乙酰化調(diào)控和人類疾病與健康的關(guān)系,也為后續(xù)YEATS結(jié)構(gòu)域靶向的小分子藥物開發(fā)奠定了基礎(chǔ)。
本論文是清華大學(xué)醫(yī)學(xué)院李海濤實驗室與美國德克薩斯大學(xué)安德森癌癥中心石曉冰實驗室的通力合作研究成果。李海濤實驗室博士后李元元和美國德克薩斯大學(xué)安德森癌癥中心聞宏博士為本文共同第一作者,實驗室研究助理任永峰和醫(yī)學(xué)院2010級博士研究生王海波參與了該項工作。李海濤博士于2010年1月加入清華大學(xué)醫(yī)學(xué)院,主要研究方向是表觀遺傳調(diào)控的分子結(jié)構(gòu)機理。目前已在包括《自然》、《細(xì)胞》在內(nèi)的學(xué)術(shù)期刊發(fā)表研究論文、綜述或圖書章節(jié)34篇,其中一作或通訊作者18篇,迄今被同行引用3100多次。本成果是繼今年年初在《自然》和《基因與發(fā)育》發(fā)文探討組蛋白甲基化識別密碼后,李海濤研究團(tuán)隊在表觀遺傳學(xué)領(lǐng)域的又一重要學(xué)術(shù)貢獻(xiàn)。本工作得到科技部973計劃、清華-北大生命科學(xué)聯(lián)合中心、生物治療協(xié)同創(chuàng)新中心、教育部新世紀(jì)優(yōu)秀人才計劃、清華大學(xué)221人才計劃、中國博士后科學(xué)基金等資助。儀器設(shè)備使用得到“鳳凰工程”蛋白質(zhì)基礎(chǔ)設(shè)施(清華)支持。衍射數(shù)據(jù)收集得到上海同步輻射光源BL17U1線站的大力支持與協(xié)助。
文章鏈接: http://www.cell.com/cell/current
供稿:醫(yī)學(xué)院 編輯:蕾蕾
